Как вылечить базальных ганглиев
| Гнпокинеэ Г | ~1 Гиперкинез |
| Двигательные нарушения | |
| Например: | Например: |
| Болезнь Паркисоиа | Хорея Гентинггона |
| Дистония | Гемнбаллизм |
| Но | |
| Болезнь Паркинсона | . Длительная терапия |
| ь далеко зашедшей ^ | препаратами леводопы, |
| стадии | Хорея Гентинггона |
^гйпокннетичкга^заболевание^априме^болеэм^Паркинсон^

Компактная |ДОФА Нео_ | I Г- с%Ун%Г стриатум^ ^БШн|
Снижение активации моторной коры
 Компактная 1ДОФА I** ‘Г
Компактная 1ДОФА I** ‘Г
часть черной | ■■ -►
^бстанцин
Толщина стрелки указывает иа выраженность активности этого пути
Болезнь Паркинсона
Болезнь Паркинсона — дегенеративное заболевание, обычно развивающееся на 4 и 7-м десятилетии жизни, причиной которого является первичная дегенерация дофаминергического нигростриарного пути с формированием клеточных включений -телец Леви. Причины возникновения заболевания в большинстве случаев неясны (идиопатическая болезнь Паркинсона; см. главу 52). Синдром паркинсонизма развивается при сосудистом поражении нигростриарного пути, терапии антагонистами дофамина при шизофрении (см. главу 50) и генетических нарушениях в молодом возрасте.
Более 50—60% дофаминергических нигростриар- ных нейронов погибает прежде чем идиопатическая болезнь Паркинсона начинает проявляться клинически. Симптомами болезни являются брадикинезия (замедленность движений), повышение мышечного тонуса по пластическому типу (симптом зубчатого колеса), а также тремор покоя. Однако у большинства больных наблюдаются когнитивные нарушения, аффективные и вегетативные расстройства, которые могут относиться к поражению структур, отличных от нигростриарного тракта.
Нейрофизиологически у этих больных отмечается повышение активности нейронов внутреннего сегмента бледного шара (БШв), который посылает воз- бужающие импульсы на субталамическое ядро (СТЯ) в результате утраты тормозных, преимущественно ингибирующих, дофаминергических влияний на нео- стриатум (НС). Повышение тормозной импульсации от БШв (и, возможно, ретикулярной части черной субстанции — ЧСр) к передневентральному и вентрола- теральному ядрам таламуса (ПВ-ВЛЯТ) приводит к снижению активации дополнительной моторной зоны (ДМЗ) и соседних отделов коры. Так, пациентам с болезнью Паркинсона трудно начинать движение, поскольку у них нарушена активация ДМЗ, при этом объяснить ригидность и тремор сложнее. На ранних стадиях состояние больных может улучшаться на фоне приема противопаркинсонических препаратов.
Противопаркинеонические препараты
Пока не создано ни одного препарата, который мог бы замедлять течение болезни Паркинсона. Для большинства больных препаратами выбора являются леводопа (заместительная дофаминовая терапия) или агонисты дофамина (сам по себе дофамин не может проникнуть через гематоэнцефалический барьер). Леводопа является предшественником дофамина и превращается в него в мозге при декарбокси- лировании. При приеме внутрь леводопа метаболи- зируется вне мозга посредством периферической ДОФА-декарбоксилазы, поэтому ее назначают вместе с ингибиторами этого фермента (карбидопой или бенсеразидом), которые помогают снизить эффективную дозу леводопы и устранить побочные эффекты (гипотензию, тошноту), возникающие в результате распространенной стимуляции дофаминовых рецепторов: тошноту и рвоту (в результате стимуляции хеморецепторной триггерной зоны), психические нарушения (например, галлюцинации и спутанность), а также дискинезии. После 5 лет лечения препаратами состояние примерно у половины пациентов ухудшается. В ряде случаев акинезия постепенно возобновляется, тогда как в других появляются дискинезии. Продолжительность действия каждой дозы дофамина может укорачиваться (феномен «изнашивания дозы»), кроме того, могут наблюдаться резкие
перепады в двигательной активности (феномен вклю- чения-выключения).
Селегилин является селективным ингибиотором моноаминооксидазы типа В (МАО-В). Он снижает метаболизм дофамина в мозге и потенциирует действие леводопы. Селегилин используют в сочетании с лево- допой для уменьшения феномена «изнашивания дозы». Ингибиторы катехол-О-метилтрансферазы (КОМТ), такие, какэнтакапон, также с недавнего времени применяют при болезни Паркинсона, они снижают периферический метаболизм леводопы и увеличивают количество препарата, поступающего в мозг.
Агонисты дофамина (ропинерол, каберголин, пра- мипексол) также используются в качестве препаратов 1-й линии при лечении болезни у лиц молодого возраста и наряду с леводопой на более поздних стадиях и у пожилых больных. Агонисты дофамина непосредственно связывают дофаминовые рецепторы в стриа- туме и черной субстанции и таким образом активируют постсинаптическую импульсацию нейронов стри- атума. Их лучше использовать у больных с ранним дебютом болезни Паркинсона с целью уменьшения в последующем феномена включения-выключения за счет дофаминсберегающего влияния этих лекарств.
К другим препаратам, которые используются при лечении болезни Паркинсона, относятся центральные холинолитики (например, циклодол), его назначают на ранних стадиях болезни при преобладании тремора. Считается, что эти препараты уменьшают гиперактивность центральной холинергической активации, которая возникает в результате прогрессирующего торможения дофаминергической активности. Побочными эффектами этих препаратов являются сухость во рту, задержка мочеиспускания, запор и спутанность сознания. С некоторым успехом для лечения тремора при болезни Паркинсона применяли (3-адреноблокаторы.
Несмотря на то что состояние большинства пациентов с болезнью Паркинсона может улучшаться на фоне приема лекарств, разработаны хирургические методы лечения вдалеке зашедших стадиях заболевания. При болезни Паркинсона отмечается повышенная активация внутреннего сегмента бледного шара и ЧСр, которая отчасти поддерживается возбуждающими импульсами от субталамического ядра. Недавно были предложены методы лечения, заключающиеся в разрушении БШв (паллидотомия) и внедрении электродов для стимуляции глубинных ядер (БШв или СТЯ). Эти манипуляции приводят к временным изменениям по типу блока проведения (см. главы 6 и 8) и, возможно, будут внедрены в клиническую практику. Они, по-видимому, смогут не только помочь в лечении осложнений, вызванных приемом лекарств, но и уменьшить основные неврологические проявления заболевания. Альтернативный подход к разрушению глубинных ядер мозга или имплантации электродов в них — это имплантация дофаминергической ткани в стриатум для замещения и возможного восстановления нигрост- риарного пути. Операции по имплантации фетальных тканей были успешно проведены у отдельных больных болезнью Паркинсона, хотя более ранние попытки ауто-трансплантатов, вырабатывающих катехоламины, были безуспешными. Во всехслучаяхуспех лечения был связан с реактивацией соответствующих отделов коры, однако наблюдались отсроченные побочные эффекты в виде посттрансплантационных дискинезий.
Хорея Гентингтона
Хорея Гентингтона — наследственное аутосомно- доминантное заболевание, связанное с увеличением числа тринуклеотидных повторов в гене, кодирующем белок гентингтин на 4-й хромосоме (см. главу 55).
Характерными симптомами болезни являются прогрессирующая деменция и насильственные движения, обычно в форме хореи — быстрые, напоминающие танец движения, обычно в руках и шее. Этот тип движений по природе является гиперкинетическим, в отличие от гипокинетического при болезни Паркинсона, и отражает наличие первичного поражения нейронов стриатума. Это приводит к относительному торможению СТЯ и уменьшению тормозных влияний БШв и ЧСр, что в свою очередь вызывает гиперактивацию двигательных зон коры и избыточные движения.
Лечение хореи Гентингтона направлено на уменьшение дофаминергической стимуляции в базальных ганглиях, однако оно не всегда сопровождается улучшением состояния больных. Как и при болезни Паркинсона, были достигнуты некоторые успехи при имплантации фетальных тканей в базальные ганглии.
Другие заболевания базальных ганглиев
Другим примером гиперкинетических расстройств служит гемибаллизм, который проявляется броско- выми движениями конечностей контралатерально поражению субталамического ядра.
Базальные ганглии поражаются и при некоторых других заболеваниях: болезни Вильсона-Коновалова (аутосомно-рецессивное заболевание, сопровождающееся нарушением обмена меди), хорее Сцценгама (последствие ревматизма), митохондриальных заболеваниях (митохондриальные цитопатии; см. главу 55), некоторых интоксикациях (отравление угарным газом и марганцем), хореоатетоидном церебральном параличе (атетоз — это патологические насильственные червеобразные движения дистальных отделов конечностей).
Двигательные нарушения, которые возникают при этих заболеваниях, различны, поскольку при них, как правило, не происходит поражения строго определенных структур экстрапирамидной системы. У больных могут развиваться синдромы паркинсонизма, хореи, баллизма или дистонии, при которой конечность принимает патологическую позу.
При болезни Паркинсона и хорее Гентингтона наблюдаются когнитивные нарушения различной выраженности вплоть до деменции. К их возникновению приводит поражение коры мозга, хотя в настоящее время получены данные о том, что деменция может развиваться при непосредственном страдании базальных ганглиев, что связано с поражением их вентральных отделов.
Базальные ганглии играют важную роль в регуляции движений глаз (см. главу 40), и у многих пациентов с заболеваниями базальных ганглиев отмечаются патологические движения глаз, что может помочь в установлении правильного диагноза.
Ростральное интеретици- >апьное ядро МПП , | ||||||||||||||||||||||||||||||
—1 Н Парамедиан ная ретикулярная формация моста | ||||||||||||||||||||||||||||||
Вертикальные движения глаз | ||||||||||||||||||||||||||||||
Горизонтальные ! движения глаз | ||||||||||||||||||||||||||||||
Ядро III пары ЧМН Ядро IV пары ЧМН Медиальный продольный пучок | ||||||||||||||||||||||||||||||
Вестибулярные ядра Парамедианная ретикулярная У формация моста (ПРФМ) | ||||||||||||||||||||||||||||||
—• Тормозной импульс —► Возбуждающий импульс | ||||||||||||||||||||||||||||||

Регуляция точных движений глаз осуществляется рядом структур — от глазодвигательных мышц до лобной коры, а нарушения этой регуляции проявляются двоением в глазах (диплопия), нечеткостью зрения или осциллопсией (колебания зрительного образа). В клинической практике поражение Ш-ей, Г/-Й иУ1-Й пар ЧМН приводит кдиплопии (например. при миастении; см. главу 7). демиелинизирую- щих заболеваниях (рассеянный склероз), поражающих медиальный продольный пучок (МПП).
Виды движений глаз
Выделяют 3 основных вида движений глаз:
• Следящие движения позволяют точно отслеживать предметы и осуществляются задними отделами коры, примыкающими к мозжечку.
• Саккадированные движения глаз позволяют переключать внимание с одного объекта на другой и осуществляются передними отделами коры, базальными ганглиями и верхними бугорками четверохолмия среднего мозга.
• Фиксация взора осуществляется преимущественн о стволом мозга (парамедианной ретикулярной формацией моста — ПРФМ) и ростральным интерстициальным ядром МПП.
Движения глаз, как и движения в целом, могут быть произвольными (при поступлении команды из коркового центра взора) и рефлекторными (при поступлении команды от подкорковых структур и задней теменной коры).
К глазодвигательным нарушениям относятся нарушения содружественных движений глазных яблок, следящих саккадирующих движений, парезы взора и нистагм. Нистагм — это двухфазное колебание глазных яблок в виде патологической медленной и корригирующей быстрой фаз. Последнее определяет направление нистагма.
Анатомия и физиология отделов ЦНС, регулирующих движения глаз
Корковый центр взора (КЦВ, преимущественно поле 8 по Бродману) находится кпереди от премо- торной коры (см. главу 35). Стимуляция этой структуры вызывает движение глаз, обычно саккадиро- ванное в противоположную сторону, которое наблюдается у больных эпилепсией.
Поражение ПРФМ приводит к невозможности посмотреть в противоположную сторону, поэтому пациент как бы смотрит на очаг. КЦВ получает импульсацию от задней теменной коры и проецируется на верхние бугорки четверохолмия, другие стволовые центры и базальные ганглии.
Задняя теменная кора (соответствует полю 7 по Бродману у обезьян) содержит большое количество нейронов, отвечающих за движения под контролем зрения в ответ на сложные зрительные стимулы (см. главу 30). Этот отдел имеет важное значение в генерации саккад в сторону предметов, представляющих зрительный интерес, посредством связей с корковым центром взора и верхними бугорками четверохолмия.
Поражение этой области, помимо нарушений зрительного внимания и нарушения саккадирован- ных движений глазных яблок в противоположном поле зрения, приводит также к нарушению следящих движений глаз, что проявляется утратой оптокинетического рефлекса. Этот рефлекс вызывается при фиксированном взгляде на какой-то вращающийся предмет, например барабан, с вертикальными линиями.
Первичная зрительная кора (ПЗК) связана с эк- страстриарными отделами и участвует как в реализации саккад, так и в следящих движениях глаз (см. главы 24 и 25). Саккады осуществляются посредством связи ПЗК с верхними бугорками четверохолмия, тогда как следящие движения глаз — посредством экстрастриарного отдела зрительной коры У5 (см. главу 25), а также ее связей с КЦВ и мостом.
Поражение стриарных и экстрастриарных отделов приводит к возникновению дефектов полей зрения и особых нарушений зрения (см. Главу 25), а также нарушений следящих движений глаз.
Базальные ганглии играют важную роль в реализации саккад (см. главы 38 и 39). Хвостатое ядро получает импульсацию от КЦВ и проецируется через ретикулярную часть черной субстанции на верхние бугорки четверохолмия.
Клинически нарушения саккадированных движений глаз наблюдаются при некоторых заболеваниях базальных ганглиев, наример при болезни Паркинсона отмечаются неточные саккады с недоведением взора до интересующего объекта (гипометрические саккады).
Важную роль в точном осуществлении саккад играют верхние бугорки четверохолмия.
Мозжечок и вестибулярные ядра посылают сложные импульсы в глазодвигательную систему ствола мозга и особенно важны при выполнении следящих движений глаз, а также реализации окуловестибу- лярных рефлексов (см. главы 28, 37 и 47).
Поражение мозжечка и вестибулярного анализатора приводит к нарушению следящих движений глаз, неточным саккадам и нистагму.
Ростральное интерстициальное ядро медиального продольного пучка регулирует вертикальные саккады и вертикальный взор (вверх и вниз) и получает импульсацию от коркового центра взора и верхних бугорков четверохолмия, проецируясь на глазодвигательные ядра.
Поражение этой структуры и прерывание ее афферентных импульсов приводят к нарушению движений обоих глаз и может наблюдаться при ряде состояний, включая некоторые нейродегенеративные заболевания.
ПРФМ получает импульсы от КЦВ, верхних бугорков четверохолмия и мозжечка и отвечает за горизонтальные саккады и взор. Эта структура работает вместе с другим ядром моста, промежуточным ядром шва. Оно содержит нейроны, которые в норме посылают тонические тормозные импульсы к активным нейронам ПРФМ и РИЯМПП, опосредуя саккадный импульс.
Поражение промежуточного ядра шва приводит к развитию опсоклонуса и беспорядочным движениям глаз. Поражение ПРФМ вызывает нарушение саккад и парез взора в свою сторону.
МПП осуществляет содружественные движения глазных яблок с помощью связей между всеми глазодвигательными ядрами и чаще поражается при таких заболеваниях ЦНС, как рассеянный склероз (см. главу 54).
Поражение этой структуры приводит к развитию межъядерной офтальмоплегии, при этом возникают нистагм в приведенном глазе и замедление или отсутствие приведения другого глаза.
- Наследственно-дегенеративные заболевания базальных ганглиев
- Глава 38. Базальные ганглии: анатомия и физиология
- ГЛАВА 4 Расстройства движений и позы вследствие поражения базальных ганглиев
- БАЗАЛЬНЫЕ ГАНГЛИИ
- Пример центральной системы: базальные ганглии
- Структура базальных ганглиев
- ФУНКЦИОНАЛЬНАЯ И НЕЙРОХИМИЧЕСКАЯ АНАТОМИЯ БАЗАЛЬНЫХ ГАНГЛИЕВ
- ГЛАВА 7 Лечение больных алкоголизмом, сочетающимся с тяжелыми сопутствующими заболеваниями внутренних органов и нервной системы. Особенности лечения больных алкоголизмом в подростково-юношеском и пожилом возрасте. Лечение женщин
- Глава 6 Лечение других заболеваний
- Глава 3 Лечение пиявками различных заболеваний
- Глава 31 Лечение наркологических заболеваний. Неотложные состояния
Источник
Функции базальных ганглиев:
интегрируют ощущения и двигательные функции;
регулируют мелкую моторику;
подавляют нежелательную двигательную активность, определяют базовый уровень тревожности;
усиливают мотивацию;
участвуют в формировании ощущения удовольствия/экстаза.
Система базальных ганглиев
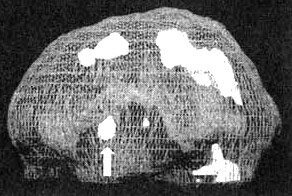
Трехмерное изображение — активный мозг, вид сбоку.
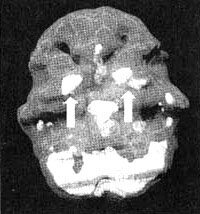
Трехмерное изображение — активный мозг, вид снизу.
Базальные ганглии — это комплекс крупных образований, расположенных в центральной части мозга окружающих центральную лимбическую систему.
Базальные ганглии участвуют в процессах интегрирования чувств, мыслей и движений, а также в регулировании моторной функции. Базальные ганглии задают наше у организму режим, а котором он работает а состоянии покоя или уровень тревожности. Кроме того, они способствуют модулированию мотивации и, по всей вероятности, отдают за ощущения удовольствия и экстаза. Рассмотрим каждую из этих функций более подробно.
Итак, в базальных ганглиях происходит процесс интеграции чувств, мыслей и движений. Именно поэтому, приходя в возбуждение, вы вскакиваете, нервничая — дрожите, пугаясь — застываете на месте, или стоите, будучи не в состоянии вымолвить ни слова, когда начальник устраивает вам разнос. Базальные ганглии отвечают за постепенную интеграцию эмоций, мыслей и движений, поэтому при перегрузке просто отключаются. Один из моих пациентов получил тяжелые ожоги в ДТП. Когда он, объятый пламенем, лежал на асфальте, те, кто находились поблизости, от ужаса застыли без движения и не могли сделать ни шагу, чтобы оказать ему помощь. Долгие годы он не мог отделаться от неприятного чувства и понять, отчего никто не шевельнулся, чтобы ему помочь. Его мучили мысли: «Неужели им было все равно? Неужели я недостоин помощи?» Долгие годы этот человек жил с физической болью от полученных травм и с душевной болью от безучастности, с которой он столкнулся. С каким же облегчением он узнал, что дело не в безучастности. Эмоциональное потрясение от самого вида аварии создало чрезмерную нагрузку на базальные ганглии очевидцев. В результате они просто утратили способность двигаться, несмотря на то что, скорее всего, хотели помочь.
Когда базальные ганглии гиперактивны (как это бывает у лиц с повышенной тревожностью), возрастает вероятность того, что для такого человека стрессовая ситуация окажется чрезмерной, а сам он и мысли его замрут. Людей со сниженной активностью базальных ганглиев (как у лиц с синдромом дефицита внимания) именно стрессовая ситуация может подтолкнуть к действию. Именно такие люди первыми оказываются на месте происшествия и довольно бесстрашно реагируют на стрессовую ситуацию. Например, один из моих друзей, страдающий СДВ, в критических ситуациях действует гораздо быстрее, чем я. (Как я уже упоминал в главе 2, у меня врожденная повышенная активность базальных ганглиев.) Помню, однажды мы с ним собирались уходить из кафе и встали к кассе оплатить свой чек, как вдруг стоявшая перед нами женщина рухнула на землю. Мой друг стал быстро оказывать ей помощь, а сам я от неожиданности и стресса застыл без движения. При этом сам-то я — медик, а мой приятель — нет! Раньше из-за неспособности быстро реагировать в подобные моменты я постоянно терзался чувством вины. Впоследствии я с облегчением понял, что действовать быстро в критических ситуациях мне не позволяет мой мозг, точнее, деятельность базальных ганглиев.
Базальные ганглии отвечают и за мелкую моторику, координацию движений, письмо и т. д. Давайте в качестве примера вновь обратимся к синдрому дефицита внимания. У многих пациентов с СДВ, как детей, так и взрослых, ужасный почерк. Им тяжело дается сам процесс письма. Многие взрослые и подростки с СДВ предпочитают писать печатными буквами, поскольку такое действие не требует длительного непрерывного и плавного движения. Многие, страдающие СДВ, жалуются, что им трудно формулировать свои мысли и излагать их на бумаге. Мы знаем, что при СДВ помогают лекарственные препараты — психостимуляторы Ritalin, Dexedrine или Adderall, стимулирующие выработку базальными ганглиями нейротрансмиттера дофамина. После приема этих препаратов нередко наблюдается значительное улучшение почерка и способности письменно излагать свои мысли. Кроме того, сами пациенты рассказывают, что прием этих препаратов в целом улучшает их двигательную координацию. В качестве примера вот два образца почерка одного и того же пациента Томми (14 лет) до и после лечения.
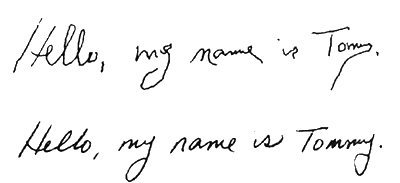
Лучше разобраться в том, за какие моторные функции отвечают базальные ганглии, можно, рассмотрев два заболевания: болезнь Паркинсона и синдром Туретта. Болезнь Паркинсона вызвана дефицитом дофамина в базальных ганглиях. Она проявляется тремором рук, мышечной ригидностью, затрудненными движениями, бедной мимикой, неловкостью и снижением двигательной активности. Часто применение таких препаратов, стимулирующих выработку дофамина, как I-dopa, значительно облегчает эти симптомы, давая больным возможность двигаться легче и более плавно. Базальные ганглии отвечают и за подавление нежелательной двигательной активности. Когда в этой части мозга возникают нарушения, повышается риск развития синдрома Туретта, проявляющегося в сочетании моторных и вокальных тиков. К рассмотрению этого состояния мы еще вернемся.
Основываясь на полученных изображениях мозга, мы видим, что базальные ганглии отвечают за управление организмом в состоянии покоя или за уровень тревожности. Повышенная активность базальных ганглиев часто связана с тревожностью, напряжением, настороженностью и повышенным страхом. Недостаток активности базальных ганглиев вызывает проблемы, связанные с мотивацией, энергетикой и способностью действовать.
Любопытно, что среди лиц с самой высокой степенью мотивации (например, генеральные директора компаний), которые прошли процедуру сканирования, мы отметили высокую активность этой части мозга. Таким образом, мы можем предположить, что в некоторых случаях повышенная активность базальных ганглиев стимулирует мотивацию, благодаря чему эти люди становятся «двигателями» общества. Скажем, моя мать, у которой, как и у меня, активность базальных ганглиев слегка повышена, временами бывает немного тревожна, но при этом она очень активная женщина. Четыре или пять раз в неделю она играет в гольф, без видимого напряжения вырастила семерых детей и вечно хлопочет, делая что-то для других. Я полагаю, что, используя таким образом избыток энергии, образующийся при повышенной активности базальных ганглиев, она тем самым не дает развиться тревожности.
Еще одно любопытное открытие состоит в том, что, по всей видимости, базальные ганглии участвуют в управлении чувством удовольствия. В нью-йоркской лаборатории Brookhaven National Laboratory группа под руководством Норы Волковой исследовала изображения мозга, чтобы понять, на какие центры воздействуют кокаин и Ritalin. Оба вещества поглощаются главным образом базальными ганглиями. К кокаину привыкание развивается, а к Ritalin, в дозах, которые назначаются при СДВ, — нет. Это исследование позволило с уверенностью ответить на вопрос, отчего так происходит. Кокаин сильно увеличивает потребление дофамина тканями мозга. Концентрация этого вещества стремительно возрастает, а затем так же стремительно снижается. Человека, употребляющего кокаин, подхватывает волна удовольствия, но потом она уходит, и тогда ему (или ей) хочется вновь пережить это ощущение. В отличие от кокаина, Ritalin, тоже обеспечивая в базальные ганглии приток дополнительных объемов дофамина, действует мягче, причем после его применения уровень дофамина снижается медленнее. Группа Волковой выдвинула гипотезу, по которой тяга к кокаину вызывается и закрепляется активизацией базальных ганглиев. Ritalin, в свою очередь, повышает мотивацию, способность сосредоточиваться и фокусировать внимание на протяжении длительных отрезков времени, но при этом не вызывает «прихода» и стремления принять его еще. (Мы не рассматриваем случаи, когда человек использует этот препарат в дозах, значительно превышающих используемые в клинической практике.) Таким образом, привыкания не возникает. На самом деле, назначая этот препарат подросткам с СДВ, я нередко сталкиваюсь с тем, что они попросту забывают его принимать.
Сильное любовное чувство воздействует на мозг во многом подобно кокаину, высвобождая мощный заряд дофамина в базальных ганглиях. Любовь на самом деле производит выраженный физический эффект. Как-то раз я сканировал головной мозг своего приятеля Билла вскоре после того, как он познакомился со своей возлюбленной. Он был влюблен в нее, что называется, по уши. После третьего свидания, которое они провели на берегу океана в объятиях друг друга, он пришел ко мне на работу рассказать о своей новой любви. Он был так счастлив, что его состояние напоминало эйфорию. И так уж случилось, что, пока Билл сидел у меня, ко мне зашел наш техник и сообщил, что у нас осталась лишняя доза изотопа, а потому, если мне надо сделать внеплановое сканирование, то такая возможность есть. У меня уже был снимок мозга моего приятеля, который я сделал для контрольной группы, в которой хранятся снимки с нормальной мозговой функцией. И тут я решил сделать ему повторный снимок. То, что я увидел, меня без преувеличения потрясло. Его мозг выглядел так, как если бы он находился под воздействием большой дозы кокаина. Активность базальных ганглиев и слева, и справа была чрезвычайно высокой, почти как во время судорог. Любовь оказывает на мозг такое же мощное воздействие, как наркотические средства.
Мозг Билла — мозг влюбленного человека
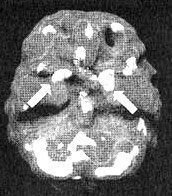
Трехмерное изображение — активный мозг, вид снизу. Обратите внимание на повышенную активность базальных ганглиев слева и справа (помечено стрелками).
Источник


