Как вылечить острый лимфобластный лейкоз
Суть болезни
Лейкоз, или лейкемия – заболевание костного мозга, в обиходе иногда называемое «раком крови». При лейкозе нарушено нормальное кроветворение: производится избыточное количество аномальных незрелых клеток крови, обычно предшественников лейкоцитов. Эти бластные клетки, размножаясь и накапливаясь в костном мозге, мешают выработке и функционированию нормальных клеток крови, что и обусловливает основные симптомы заболевания. Кроме того, эти опухолевые клетки могут накапливаться в лимфоузлах, печени, селезенке, центральной нервной системе и других органах, также вызывая появление специфических симптомов.
Как известно, различные клетки крови развиваются по-разному и имеют разных предшественников – то есть относятся к различным линиям кроветворения (см. схему в статье «Кроветворение»). Линия кроветворения, приводящая к появлению лимфоцитов, называется лимфоидной; остальные же лейкоциты относятся к миелоидной линии. Соответственно, различают лейкозы из клеток-предшественников лимфоцитов (такие лейкозы называют лимфобластными, лимфоцитарными или просто лимфолейкозами) и из предшественников других лейкоцитов (миелобластные, миелоидные, миелолейкозы).
Острый лимфобластный лейкоз (ОЛЛ) – самый распространенный вид лейкоза у детей, но это заболевание нередко встречается и во взрослом возрасте. Термин «острый» означает быстрое развитие болезни, в противоположность хроническому лейкозу. Термин «лимфобластный» означает, что незрелые клетки, составляющие основу болезни, являются лимфобластами, то есть предшественниками лимфоцитов.
Частота встречаемости и факторы риска
На долю ОЛЛ приходится 75-80% всех опухолевых заболеваний кроветворной системы у детей (3-4 случая на 100 тысяч детей в год). Именно ОЛЛ – самое распространенное онкологическое заболевание у детей. Чаще всего ОЛЛ возникает в возрасте до 14 лет; пик детской заболеваемости приходится на возраст 2-5 лет. У мальчиков эта болезнь встречается чаще, чем у девочек.
Вероятность возникновения ОЛЛ несколько повышена у людей, ранее получавших лечение от какой-либо другой болезни (обычно злокачественной опухоли) с использованием облучения или определенных видов цитостатической химиотерапии. Также риск ОЛЛ повышен у детей с некоторыми генетическими нарушениями – например, с синдромом Дауна, нейрофиброматозом типа I или первичными иммунодефицитными состояниями.
Риск заболеть для ребенка выше среднего, если у его брата- или сестры-близнеца уже был диагностирован лейкоз.
Впрочем, в большинстве случаев лейкоза не удается обнаружить никакого из перечисленных факторов риска, и причины, вызвавшие болезнь, остаются неизвестными.
Признаки и симптомы
ОЛЛ характеризуется множеством различных признаков и у разных больных может проявляться по-разному. Большинство наблюдаемых симптомов, однако, обусловлено тяжелыми нарушениями кроветворения: избыток аномальных бластных клеток при ОЛЛ сочетается с недостаточным количеством нормальных функциональных клеток крови.
Обычно наблюдаются слабость, бледность, снижение аппетита, потеря веса, учащенное сердцебиение (тахикардия) – проявления анемии и опухолевой интоксикации. Недостаток тромбоцитов проявляется мелкими кровоизлияниями на коже и слизистых оболочках, кровотечениями из десен, носовыми и кишечными кровотечениями, кровоподтеками, синяками. Из-за накопления бластных клеток часто увеличиваются лимфоузлы – в частности, шейные, подмышечные, паховые. Нередко увеличиваются также печень и селезенка — как говорят, возникает гепатоспленомегалия.
Часто наблюдаются боли в костях и суставах, иногда возникают патологические (то есть вызванные заболеванием) переломы костей. Из-за недостаточного количества нормальных зрелых лейкоцитов возможны частые инфекции. Повышение температуры может наблюдаться как в связи с возникшей на фоне лейкоза инфекцией, так и из-за опухолевой интоксикации. Иногда одним из проявлений острого лейкоза является продолжительная ангина, плохо поддающаяся терапии антибиотиками.
В некоторых случаях ОЛЛ вызывает изменения и в других органах: глазах, почках, яичках у мальчиков и яичниках у девочек, причем у мальчиков поражение половых органов наблюдается чаще. Нередко возникает поражение центральной нервной системы — нейролейкемия.
Так как все наблюдаемые симптомы могут быть связаны и с другими заболеваниями и не специфичны для ОЛЛ, перед началом лечения необходима лабораторная диагностика, которая в срочном порядке производится в больничных условиях.
Диагностика
При ОЛЛ возникают изменения в обычном клиническом анализе крови: понижены уровни эритроцитов и тромбоцитов, появляются бластные клетки. Очень высокий лейкоцитоз возможен, но, вопреки распространенному мнению, наблюдается не во всех случаях. В целом же надежно поставить диагноз можно только при исследовании образца костного мозга; для этой цели необходима костномозговая пункция.
При морфологическом исследовании диагноз «острый лимфобластный лейкоз» ставится при обнаружении более 25% бластных клеток в костном мозге. Но обязательно производятся более тонкие исследования: цитохимическое (окрашивание клеток, позволяющее более точно установить их природу), цитогенетическое (изучение строения хромосом в лейкемических клетках), иммунофенотипирование (изучение белковых молекул на поверхности клеток). Дело в том, что при диагностике очень важно не только надежно отличить ОЛЛ от острого миелоидного лейкоза, но и определить конкретный вариант ОЛЛ, поскольку он сильно влияет на терапию и прогноз заболевания.
Так, ОЛЛ может быть B-клеточным (около 80% случаев) и T-клеточным, в зависимости от того, относятся ли лейкемические клетки к B- или T-лимфоцитарной линии. В зависимости от «степени зрелости» бластных клеток среди как В-, так и Т-клеточных лейкозов выделяют несколько вариантов; их установление в ходе иммунофенотипирования важно для определения стратегии лечения.
В ходе диагностики ОЛЛ также необходимо исследовать состояние центральной нервной системы. Анализ спинномозговой жидкости (ликвора) позволяет определить, нет ли у больного поражения центральной нервной системы – нейролейкемии. Образец ликвора для анализа получают посредством пункции спинномозгового канала.
Возможны и дополнительные диагностические процедуры для исследования пораженных лимфоузлов и внутренних органов – компьютерная томография (КТ), ультразвуковое исследование (УЗИ) и так далее.
Диагностические исследования позволяют для каждого конкретного больного определить ту или иную группу риска, от которой зависят прогноз заболевания и планируемое лечение. Так, говорят о стандартном риске, высоком риске и т.д. Отнесение к той или иной группе зависит от многих факторов. Перечислим некоторые из них.
- Возраст больного: менее благоприятным считается возраст до 1 года или старше 10 лет.
- Количество лейкоцитов: риск увеличивается при очень высоком лейкоцитозе в момент диагноза.
- Т-клеточный ОЛЛ у детей обычно определяет более высокий риск (худший прогноз) по сравнению с В-клеточным.
- Хромосомные аномалии в лейкемических клетках, связанные с числом хромосом и транслокациями. При некоторых из них усложняется лечение болезни и ухудшается прогноз. Так, особенно неблагоприятна филадельфийская хромосома – транслокация t(9;22). В то же время, например, транслокация t(12;21) связана с относительно хорошим прогнозом.
- Распространение ОЛЛ в другие органы, помимо костного мозга (например, возникновение нейролейкемии), определяет более высокий риск.
- При раннем или повторном рецидиве лейкоза риск значительно повышается.
Лечение
Как упомянуто в предыдущем разделе, современное лечение ОЛЛ основано на разделении пациентов на группы риска – в зависимости от того, насколько вероятно у них достижение и сохранение ремиссии при одинаковой терапии. Соответственно, пациенты, относящиеся к группам более высокого риска (то есть те, у кого изначальный прогноз хуже), получают более интенсивную терапию, а в группах более низкого риска можно использовать менее интенсивную терапию и тем самым избегать излишней токсичности и тяжелых осложнений.
Терапия ОЛЛ, как правило, состоит из трех этапов:
Индукция ремиссии (то есть терапия, направленная на достижение ремиссии) проводится в течение нескольких первых недель лечения. Под ремиссией здесь подразумеваеся содержание менее 5% бластных клеток в костном мозге и отсутствие их в обычной (периферической) крови в сочетании с признаками восстановления нормального кроветворения.
В ходе индукции проводится интенсивная многокомпонентная химиотерапия лекарствами-цитостатиками, которые вызывают разрушение лейкемических клеток. На этом этапе могут применяться такие лекарства, как винкристин, гормоны-глюкокортикостероиды, аспарагиназа, антрациклины (даунорубицин и др.), иногда и другие препараты. Индукция позволяет достигнуть ремиссии более чем у 95% детей и у 75-90% взрослых с ОЛЛ.Консолидация (закрепление) ремиссии направлена на уничтожение остаточных аномальных бластных клеток во избежание рецидива заболевания. Общая продолжительность этого этапа составляет несколько месяцев и сильно зависит от конкретного протокола лечения. В ходе курсов терапии на этапе консолидации могут использоваться метотрексат, 6-меркаптопурин, винкристин, преднизолон, а также циклофосфамид, цитарабин, даунорубицин, аспарагиназа и т.д.
На этапах индукции и консолидации введение химиотерапевтических препаратов производится в основном внутривенно, в условиях больничного стационара или стационара одного дня.Поддерживающая терапия проводится для поддержания ремиссии, то есть для дополнительного снижения риска рецидива после этапов индукции и консолидации. Продолжительность поддерживающей терапии – 2-3 года. На этом этапе основными препаратами являются 6-меркаптопурин и метотрексат.
Поддерживающая терапия представляет собой этап наименее интенсивного лечения. Лекарства принимаются в виде таблеток, пребывание в больнице при этом не требуется.
Для лечения и профилактики нейролейкемии на перечисленных этапах химиопрепараты должны вводиться интратекально, то есть в спинномозговой канал посредством люмбальных пункций. Иногда лекарства вводят в желудочки (особые полости) головного мозга через специальный резервуар Оммайя, который устанавливается под кожей головы. Основной препарат, используемый для интратекального введения при ОЛЛ, — метотрексат; дополнительно также применяются цитарабин и глюкокортикостероиды. У некоторых пациентов используется и облучение головы – краниальное облучение.
Существует также понятие реиндукции: это периодически повторяемые уже после достижения ремиссии циклы полихимиотерапии, аналогичные используемым при индукции. Реиндукция позволяет дополнительно снизить число лейкемических клеток и тем самым повысить «надежность» ремиссии.
К сожалению, несмотря на все перечисленные меры, иногда возникает рецидив ОЛЛ – костномозговой, экстрамедуллярный (то есть вне костного мозга – например, с поражением центральной нервной системы или яичек) или комбинированный. В этом случае проводится противорецидивная терапия. Выбор протокола лечения рецидива зависит от сроков его возникновения (ранний или поздний) и от того, является ли рецидив костномозговым или экстрамедуллярным. К сожалению, при раннем рецидиве шансы на успех терапии значительно снижаются.
В ходе лечения ОЛЛ может применяться трансплантация костного мозга от родственного или неродственного донора. Если по плану лечения предусмотрена трансплантация, то ее проводят после достижения ремиссии. Как правило, трансплантация показана только при высоком риске (например, после раннего рецидива), поскольку вероятность хорошего ответа на стандартную терапию при ОЛЛ в среднем высока, особенно у детей.
Химиотерапия ОЛЛ высокоэффективна, но зачастую тяжело переносится и может быть связана с серьезными побочными эффектами. Так, в процессе лечения подавляется кроветворение и бывают необходимы переливания компонентов донорской крови – тромбоцитов во избежание кровотечений при очень низком уровне собственных тромбоцитов больного, эритроцитов для борьбы с анемией. Переливания донорских лейкоцитов (гранулоцитов) применяются только в редких случаях при тяжелых инфекционных осложнениях.
В числе «обычных» побочных эффектов химиотерапии можно также назвать тошноту, рвоту, облысение. Серьезнае проблема связана с возможностью аллергических реакций на химиопрепараты, вплоть до анафилактического шока – жизнеугрожающего состояния, которое характеризуется отеком, затруднением дыхания, сильным зудом и т.д. Так, сравнительно часто встречается аллергия на аспарагиназу, и может быть необходимо использование аналогов этого препарата (онкаспар, эрвиназа).
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения необходимы эффективные антибактериальные и противогрибковые лекарства для профилактики и терапии инфекционных осложнений. Опасны как обычные, так и оппортунистические инфекции. В частности, серьезную проблему представляют такие грибковые инфекции, как кандидоз и аспергиллез.
Интенсивное лечение ОЛЛ накладывает серьезные ограничения на образ жизни больного. Необходимо соблюдать определенную диету и строгие гигиенические требования. Во избежание инфекций ограничиваются контакты с внешним миром. При очень низком уровне тромбоцитов нельзя не только допускать травмы, но даже, например, чистить зубы зубной щеткой — чтобы не спровоцировать кровотечение из десен. После достижения ремиссии строгость этих ограничений постепенно снижается. Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
Прогноз
Без лечения ОЛЛ приводит к гибели больного в течение нескольких месяцев или даже недель. Однако использование современных протоколов лечения дает при ОЛЛ очень хороший результат: можно вылечить около 80% больных детей (некоторые источники приводят и более высокие цифры — например, до 85%). У взрослых, особенно пожилых, результаты хуже, но, тем не менее, примерно у 40% взрослых больных удается достичь стойкой ремиссии – то есть отсутствия рецидивов болезни в течение пяти и более лет, после чего человека можно считать здоровым.
Источник

Острый лимфобластный лейкоз – злокачественное поражение системы кроветворения, сопровождающееся неконтролируемым увеличением количества лимфобластов. Проявляется анемией, симптомами интоксикации, увеличением лимфоузлов, печени и селезенки, повышенной кровоточивостью и дыхательными расстройствами. Из-за снижения иммунитета при остром лимфобластном лейкозе часто развиваются инфекционные заболевания. Возможно поражение ЦНС. Диагноз выставляется на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
Общие сведения
Острый лимфобластный лейкоз (ОЛЛ) – самое распространенное онкологическое заболевание детского возраста. Доля ОЛЛ составляет 75-80% от общего количества случаев болезней системы кроветворения у детей. Пик заболеваемости приходится на возраст 1-6 лет. Мальчики страдают чаще девочек. Взрослые пациенты болеют в 8-10 раз реже детей. У пациентов детского возраста острый лимфобластный лейкоз возникает первично, у взрослых нередко является осложнением хронического лимфоцитарного лейкоза. По своим клиническим проявлениям ОЛЛ схож с другими острыми лейкозами. Отличительной особенностью является более частое поражение оболочек головного и спинного мозга (нейролейкоз), при отсутствии профилактики развивающееся у 30-50% пациентов. Лечение осуществляют специалисты в области онкологии и гематологии.
В соответствии с классификацией ВОЗ различают четыре типа ОЛЛ: пре-пре-В-клеточный, пре-В-клеточный, В-клеточный и Т-клеточный. В-клеточные острые лимфобластные лейкозы составляют 80-85% от общего количества случаев заболевания. Первый пик заболеваемости приходится на возраст 3 года. В последующем вероятность развития ОЛЛ повышается после 60 лет. Т-клеточный лейкоз составляет 15-20% от общего количества случаев болезни. Пик заболеваемости приходится на возраст 15 лет.
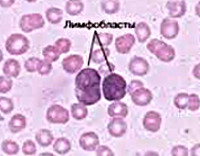
Острый лимфобластный лейкоз
Причины острого лимфобластного лейкоза
Непосредственной причиной острого лимфобластного лейкоза является образование злокачественного клона – группы клеток, обладающих способностью к неконтролируемому размножению. Клон образуется в результате хромосомных аберраций: транслокации (обмена участками между двумя хромосомами), делеции (утраты участка хромосомы), инверсии (переворота участка хромосомы) или амплификации (образования дополнительных копий участка хромосомы). Предполагается, что генетические нарушения, вызывающие развитие острого лимфобластного лейкоза, возникают еще во внутриутробном периоде, однако для завершения процесса формирования злокачественного клона нередко требуются дополнительные внешние обстоятельства.
В числе факторов риска возникновения острого лимфобластного лейкоза обычно в первую очередь указывают лучевые воздействия: проживание в зоне с повышенным уровнем ионизирующей радиации, радиотерапию при лечении других онкологических заболеваний, многочисленные рентгенологические исследования, в том числе во внутриутробном периоде. Уровень связи, а также доказанность наличия зависимости между различными лучевыми воздействиями и развитием острого лимфобластного лейкоза сильно различаются.
Так, взаимосвязь между лейкозами и лучевой терапией в наши дни считается доказанной. Риск возникновения острого лимфобластного лейкоза после радиотерапии составляет 10%. У 85% пациентов болезнь диагностируется в течение 10 лет после окончания курса лучевой терапии. Связь между рентгенологическими исследованиями и развитием острого лимфобластного лейкоза в настоящее время остается на уровне предположений. Достоверных статистических данных, подтверждающих эту теорию, пока не существует.
Многие исследователи указывают на возможную связь между ОЛЛ и инфекционными заболеваниями. Вирус возбудителя острого лимфобластного лейкоза пока не выявлен. Существуют две основные гипотезы. Первая – ОЛЛ вызывается одним пока не установленным вирусом, однако болезнь возникает только при наличии предрасположенности. Вторая – причиной развития острого лимфобластного лейкоза могут стать разные вирусы, риск развития лейкоза у детей повышается при недостатке контактов с патогенными микроорганизмами в раннем возрасте (при «нетренированности» иммунной системы). Пока обе гипотезы не доказаны. Достоверные сведения о наличии связи между лейкозами и вирусными заболеваниями получены только для Т-клеточных лейкозов у взрослых больных, проживающих в странах Азии.
Вероятность развития острого лимфобластного лейкоза повышается при контакте матери с некоторыми токсическими веществами в период гестации, при некоторых генетических аномалиях (анемии Фанкони, синдроме Дауна, синдроме Швахмана, синдроме Клайнфельтера, синдроме Вискотта-Олдрича, нейрофиброматозе, целиакии, наследственно обусловленных иммунных нарушениях), наличии онкологических заболеваний в семейном анамнезе и приеме цитостатиков. Некоторые специалисты отмечают возможное негативное влияние курения.
Симптомы острого лимфобластного лейкоза
Болезнь развивается стремительно. К моменту постановки диагноза суммарная масса лимфобластов в организме может составлять 3-4% от общей массы тела, что обусловлено бурной пролиферацией клеток злокачественного клона на протяжении 1-3 предыдущих месяцев. В течение недели количество клеток увеличивается примерно вдвое. Различают несколько синдромов, характерных для острого лимфобластного лейкоза: интоксикационный, гиперпластический, анемический, геморрагический, инфекционный.
Интоксикационный синдром включает в себя слабость, утомляемость, лихорадку и потерю веса. Повышение температуры может провоцироваться как основным заболеванием, так и инфекционными осложнениями, которые особенно часто развиваются при наличии нейтропении. Гиперпластический синдром при остром лимфобластном лейкозе проявляется увеличением лимфоузлов, печени и селезенки (в результате лейкемической инфильтрации паренхимы органов). При увеличении паренхиматозных органов могут появляться боли в животе. Увеличение объема костного мозга, инфильтрация надкостницы и тканей суставных капсул могут становиться причиной ломящих костно-суставных болей.
О наличии анемического синдрома свидетельствуют слабость, головокружения, бледность кожи и учащение сердечных сокращений. Причиной развития геморрагического синдрома при остром лимфобластном лейкозе становятся тромбоцитопения и тромбозы мелких сосудов. На коже и слизистых выявляются петехии и экхимозы. При ушибах легко возникают обширные подкожные кровоизлияния. Наблюдаются повышенная кровоточивость из ран и царапин, кровоизлияния в сетчатку, десневые и носовые кровотечения. У некоторых больных острым лимфобластным лейкозом возникают желудочно-кишечные кровотечения, сопровождающиеся кровавой рвотой и дегтеобразным стулом.
Иммунные нарушения при остром лимфобластном лейкозе проявляются частым инфицированием ран, царапин и следов от уколов. Могут развиваться различные бактериальные, вирусные и грибковые инфекции. При увеличении лимфатических узлов средостения отмечаются нарушения дыхания, обусловленные уменьшением объема легких. Дыхательная недостаточность чаще обнаруживается при Т-клеточном остром лимфобластном лейкозе. Нейролейкозы, спровоцированные инфильтрацией оболочек спинного и головного мозга, чаще отмечаются во время рецидивов.
При вовлечении ЦНС выявляются положительные менингеальные симптомы и признаки повышения внутричерепного давления (отек дисков зрительных нервов, головная боль, тошнота и рвота). Иногда поражение ЦНС при остром лимфобластном лейкозе протекает бессимптомно и диагностируется только после исследования цереброспинальной жидкости. У 5-30% мальчиков появляются инфильтраты в яичках. У пациентов обоих полов на коже и слизистых оболочках могут возникать багрово-синюшные инфильтраты (лейкемиды). В редких случаях наблюдаются выпотной перикардит и нарушения функции почек. Описаны случаи поражений кишечника.
С учетом особенностей клинической симптоматики можно выделить четыре периода развития острого лимфобластного лейкоза: начальный, разгара, ремиссии, терминальный. Продолжительность начального периода составляет 1-3 месяца. Преобладает неспецифическая симптоматика: вялость, утомляемость, ухудшение аппетита, субфебрилитет и нарастающая бледность кожи. Возможны головные боли, боли в животе, костях и суставах. В период разгара острого лимфобластного лейкоза выявляются все перечисленные выше характерные синдромы. В период ремиссии проявления болезни исчезают. Терминальный период характеризуется прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика острого лимфобластного лейкоза
Диагноз выставляют с учетом клинических признаков, результатов анализа периферической крови и данных миелограммы. В периферической крови пациентов с острым лимфобластным лейкозом выявляются анемия, тромбоцитопения, повышение СОЭ и изменение количества лейкоцитов (обычно – лейкоцитоз). Лимфобласты составляют 15-20 и более процентов от общего количества лейкоцитов. Количество нейтрофилов снижено. В миелограмме преобладают бластные клетки, определяется выраженное угнетение эритроидного, нейтрофильного и тромбоцитарного ростка.
В программу обследования при остром лимфобластном лейкозе входят люмбальная пункция (для исключения нейролейкоза), УЗИ органов брюшной полости (для оценки состояния паренхиматозных органов и лимфатических узлов), рентгенография грудной клетки (для обнаружения увеличенных лимфоузлов средостения) и биохимический анализ крови (для выявления нарушений функции печени и почек). Дифференциальный диагноз острого лимфобластного лейкоза проводят с другими лейкозами, отравлениями, состояниями при тяжелых инфекционных заболеваниях, инфекционным лимфоцитозом и инфекционным мононуклеозом.
Лечение и прогноз при остром лимфобластном лейкозе
Основой терапии являются химиопрепараты. Выделяют два этапа лечения ОЛЛ: этап интенсивной терапии и этап поддерживающей терапии. Этап интенсивной терапии острого лимфобластного лейкоза включает в себя две фазы и длится около полугода. В первой фазе осуществляют внутривенную полихимиотерапию для достижения ремиссии. О состоянии ремиссии свидетельствуют нормализация кроветворения, наличие не более 5% бластов в костном мозге и отсутствие бластов в периферической крови. Во второй фазе проводят мероприятия для продления ремиссии, замедления или прекращения пролиферации клеток злокачественного клона. Введение препаратов также осуществляют внутривенно.
Продолжительность этапа поддерживающей терапии при остром лимфобластном лейкозе составляет около 2 лет. В этот период больного выписывают на амбулаторное лечение, назначают препараты для перорального приема, осуществляют регулярные обследования для контроля над состоянием костного мозга и периферической крови. План лечения острого лимфобластного лейкоза составляют индивидуально с учетом уровня риска у конкретного больного. Наряду с химиотерапией используют иммунохимиотерапию, радиотерапию и другие методики. При низкой эффективности лечения и высоком риске развития рецидивов осуществляют трансплантацию костного мозга. Средняя пятилетняя выживаемость при В-клеточном остром лимфобластном лейкозе в детском возрасте составляет 80-85%, во взрослом – 35-40%. При Т-лимфобластном лейкозе прогноз менее благоприятен.
Источник


